上海正規外泌體提取試劑進貨價
由于外泌體的特殊結構和功能,使得它具有潛在的應用價值,一方面可以作為診斷多種疾病的生物指標,另一方面也可以作為治病手段,未來有可能作為藥物的天然載體用于臨床治病。外泌體的分離純化一直是科研工作者關注的問題,獲得高純度的外泌體對后續的研究至關重要。據了解,目前人們多采用超速離心、免疫磁珠、超濾、沉淀或試劑盒等方法實現外泌體的提取分離。外泌體攜帶大量特異性的蛋白質(如細胞因子、生長因子)以及功能性的mRNAs、miRNAs等生物活性物質,在體內參與細胞通訊、細胞遷移、促血管新生和抗一些病癥免疫等生理過程,與多種疾病的發生和進程密切相關。目前人們多采用超速離心、免疫磁珠、超濾、沉淀或試劑盒等方法實現外泌體的提取分離。上海正規外泌體提取試劑進貨價
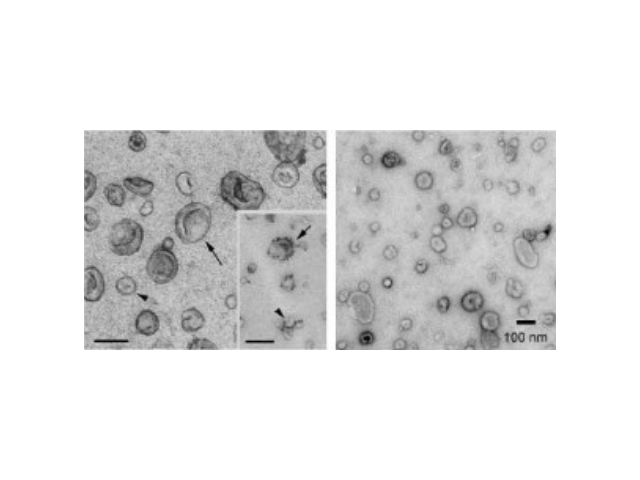
外泌體相關miRNA與肺病的診斷:miRNAs是一類含有20~25個核苷酸的非編碼小RNA,能夠通過下調或壓制靶mRNAs來調節轉錄水平上的基因表達,目前非編碼RNA被普遍發現存在于NSCLC患者外泌體中,參與一些病癥的形成和演化過程。單個miRNA可能通過壓制性復合物與多個mRNA結合,從而阻滯整個生物通路。因此,外泌體的miRNA具有成為NSCLC標志物的優勢。Chen等在152例肺病患者的研究中初次報道了循環游離miRNA的表達,與75例健康者相比,發現了兩種高表達的miRNA(miR-25和miR-223)。Rabinonowits等對27例肺病患者和9例健康人的血漿外泌體中12個miRNA的表達進行了評估,結果顯示,12個一些病癥相關的miRNA*在肺病患者中過度表達。Cazzoli等收集了30個血漿樣本,發現4種外泌體miRNA(miR-378a、-379a、-139-5p、-200b-5p)在肺病患者血清中明顯升高,用于篩查患者與健康人ROC曲線下面積(AUC)為0.908。南京外泌體提取試劑報價外泌體(Exosome)發現于1986年,是一種直徑約30~100nm的雙層膜囊泡狀結構小體。
有的外泌體分離方法需要高速離心,需要使用大型機器,耗費近24小時的時間才能獲得,非常不便。而高離心力也可能破壞囊泡。降低樣品的質量。這項研究有望解決這一難題。在論文中,研究人員們提供了一種通過微流體和聲學的獨特組合從體液樣品中捕獲外泌體的新穎方法。他們開發的原始聲學分選裝置由兩個傾斜的聲學換能器和一個微流體通道組成,當這些傳感器產生的聲波相互碰撞時,形成產生一系列壓力節點的駐波。每當細胞或顆粒流過通道并遇到一個節點時,壓力會將細胞引導離開中心一點點。細胞移動的距離取決于大小和其他屬性(如可壓縮性),這樣,當到達通道末尾時,不同大小和性質的細胞就能夠被分離開來。這種方法分離得到的外泌體,基本上不改變其生物或物理特征,為開發評估人類健康以及疾病診斷和進展提供了有吸引力的新方法。
研究探討了外泌體是否可以作為RNAi的有效載體的可能性。與脂質體和其他合成藥物納米顆粒載體不同,外泌體含有可能增強內吞作用的跨膜和膜錨定蛋白,從而促進其內容物的遞送。CD47是外泌體蛋白質之一,是一個普遍表達的整合素相關跨膜蛋白,其部分功能可以保護細胞免受吞噬作用。CD47是信號調節蛋白α(SIRPα,也稱為CD172a)的配體,CD47-SIRPα間的結合能夠發出“不要吃我”的信號,從而壓制吞噬作用。病基因RAS能夠促進胰腺病細胞增殖,增強胞飲作用從而促進一些病癥細胞攝取外泌體。合成納米顆粒對細胞有一定毒性作用,但使用外泌體能夠較小化對細胞的毒性。研究人員發現,CD47和病基因KRAS驅動的胞飲作用都會壓制外泌體被循環系統的清理,并增強胰腺病細胞對外泌體的特異性。所以,外泌體的這種特性增強了它們通過遞送RNAi來特異性靶向胰腺病中的KRAS的能力,并且使用外泌體作為單一靶向劑顯著改善了所有實驗PDAC小鼠模型的總生存期。外泌體提取:聚乙二醇(PEG)為常用的多聚物,可與疏水性蛋白和脂質分子結合共沉淀。

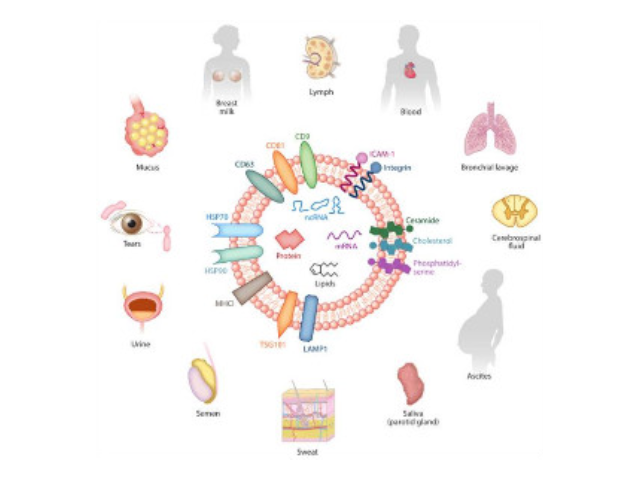
人體內多種細胞及體液均可分泌外泌體,包括內皮細胞、免疫細胞、血小板、平滑肌細胞等。當其由宿主細胞被分泌到受體細胞中時,外泌體可通過其攜帶的蛋白質、核酸、脂類等來調節受體細胞的生物學活性。外泌體介導的細胞間通訊主要通過以下三種方式:一是外泌體膜蛋白可以與靶細胞膜蛋白結合,進而靶細胞細胞內的信號通路。二是在細胞外基質中,外泌體膜蛋白可以被蛋白酶剪切,剪切的碎片可以作為配體與細胞膜上的受體結合,從而細胞內的信號通路。有報道稱一些外泌體膜上蛋白在其來源細胞膜上未能檢測出。三是外泌體膜可以與靶細胞膜直接融合,非選擇性的釋放其所含的蛋白質、mRNA以及microRNA。外泌體:形成了一種全新的細胞間信息傳遞系統,影響細胞的生理狀態并與多種疾病的發生與進程密切相關。無錫外泌體提取試劑直銷廠家
外泌體提取:樣本的粘度與分離的外泌體純度有顯著的相關性。上海正規外泌體提取試劑進貨價
外泌體的形成與鑒定:首先,細胞膜內陷形成一個杯狀結構,包括細胞表面蛋白和與細胞外環境相關的可溶性蛋白,導致早期胞內體(early-sortingendosome,ESE)的從頭形成,或者是杯狀結構直接和已經存在的ESEs融合;trans-高爾基體和內質網也能協助形成ESEs。ESE成熟后形成晚期胞內體(late-sortingendosomes,LSEs),較終形成MVBs(也稱為多囊內小體)。MVBs是通過endosome限制膜向內凹(即質膜雙凹)形成的,這一過程導致MVBs含有多個ILVs。MVB可以與溶酶體或自噬體融合,較終降解或與質膜融合釋放作為外泌體的ILVs。外泌體表面蛋白包括四聚體蛋白、整合蛋白、免疫調節蛋白等。外泌體可以包含不同類型的細胞表面蛋白、細胞內蛋白、RNA、DNA、氨基酸和代謝物。使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后上海正規外泌體提取試劑進貨價
- 正規細胞外基質膠廠家推薦 2025-02-15
- 蕪湖細胞外基質膠產品介紹 2025-02-15
- 上海正規外泌體提取試劑進貨價 2025-02-15
- 濟南正規無血清細胞凍存液哪家好 2025-02-15
- 重慶正規外泌體提取試劑平均價格 2025-02-15
- 北京外泌體提取試劑報價 2025-02-15
- 合肥正規細胞外基質膠直銷廠家 2025-02-15
- 石家莊正規外泌體提取試劑直銷廠家 2025-02-15
- 合肥鄭州細胞外基質膠 2025-02-15
- 重慶正規外泌體提取試劑廠家現貨 2025-02-15
- 浙江好用中空膠供應商家 2025-02-15
- 重慶透層添加劑哪家好 2025-02-15
- 遼寧冷補液添加劑哪家好 2025-02-15
- 福建磷脂酰絲氨酸粉末銷售 2025-02-15
- 汕尾PCMX(對氯間二甲基苯酚)售后服務 2025-02-15
- 天津電腦芯片導熱材料價格 2025-02-15
- 開利PP23BZ110005C/開利110中央空調壓縮機油供應商 2025-02-15
- 中空膠生產廠家 2025-02-15
- 湖北防水涂料瀝青乳化劑價格 2025-02-15
- 河南比澤爾B100中央空調壓縮機油 2025-02-15