-
 his標簽蛋白表達產業鏈
his標簽蛋白表達產業鏈無細胞蛋白表達技術(CFPS)的雛形可追溯至20世紀50年代。1958年,Zamecnik頭次證明細胞裂解物中的翻譯機器可在體外合成蛋白質,為技術奠定基礎。1961年,Nirenberg和Matthaei利用大腸桿菌裂解物破譯遺傳密碼子,推動了分子生物學的發展。然而,早期技術因表達量低、穩定性差,長期局限于實驗室研究,主要用于密碼子解析和翻譯機制探索,未實現規模化應用。近十年,無細胞蛋白表達技術技術加速向醫療、合成生物學等領域滲透。例如,在COVID-19期間,該技術被用于快速生產疫苗抗原和抗體。同時,AI算法的引入實現了反應條件智能預測,進一步優化表達效率。中國企業如蘇州珀羅汀生物通過自主研...
2025-07-10 -
 功能蛋白表達檢測
功能蛋白表達檢測體外蛋白表達技術的重點在于利用細胞裂解物中的生物合成機器(核糖體、tRNA、翻譯因子)在試管中直接合成蛋白質。以大腸桿菌系統為例:首先制備含T7啟動子的線性DNA模板,將其與商業化裂解物(如RocheRTS100)、能量混合物(ATP/GTP)及20種氨基酸混合,在37℃振蕩反應2-4小時即可完成蛋白表達。整個過程無需細胞培養與基因轉染,速度比傳統方法快10倍以上。例如,COVID19刺突蛋白RBD結構域的體外表達只需6小時,而HEK293細胞系統需5天。該技術的關鍵優勢是開放體系的可編程性——可直接添加非天然氨基酸(如Azidohomoalanine)合成定制化蛋白,為藥物偶聯物開發提供高效...
-
 內源蛋白表達下調
內源蛋白表達下調無細胞蛋白表達技術CFPS的開放體系特性使其對實驗環境極為敏感。裂解物中的酶活性會隨凍融次數下降,需分裝保存并避免反復凍融;反應中核酸酶殘留可能導致模板降解,常需額外添加抑制劑(如RNasin)。此外,不同批次的裂解物活性可能存在差異,導致實驗結果難以重復。例如,某研究組發現同一模板在連續三次實驗中蛋白產量波動達30%,后來通過標準化裂解物制備流程(如固定細胞生長OD值)才解決該問題。這些細節要求使得CFPS的操作容錯率較低。我們需要先??構建蛋白表達載體??,再轉染細胞。內源蛋白表達下調中國在合成生物學領域的政策布局更側重細胞工廠(如微生物發酵),對無細胞蛋白表達技術這類技術的專項扶持較少。...
2025-07-10 -
 目的蛋白表達陽性
目的蛋白表達陽性體外蛋白表達正在推動 無細胞合成生物學 的范式革新:人工代謝通路重構: 在裂解物中整合多酶級聯反應,利用底物通道效應實現小分子化合物的高轉化率合成;基因振蕩器開發: 通過T7 RNA聚合酶的自調控表達構建分子鐘,模擬細胞周期節律;仿生細胞構建: 將蛋白表達系統封裝于脂質體內,結合ATP再生模塊(如bing tong酸激酶系統)創建可自我維持的人工細胞雛形。這種 “設計-構建-測試”閉環 明顯加速了生物系統的理性設計進程。nuclera 高通量微流控蛋白表達篩選系統可助力體外蛋白表達,如想了解更多信息,歡迎咨詢官方代理商上海曼博生物!優化后的??原核體外蛋白表達??已廣泛應用于抗體篩選、酶工程等...
-
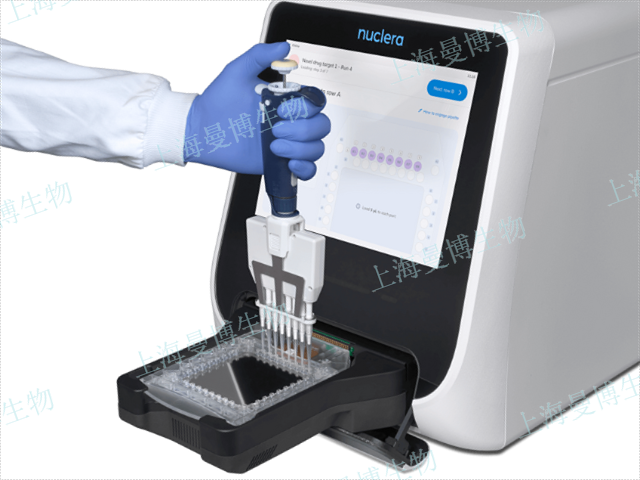 植物蛋白表達純化
植物蛋白表達純化近年來,無細胞蛋白表達技術(CFPS)市場呈現快速增長趨勢,主要受益于生物醫藥研發和合成生物學的需求激增。根據市場分析報告,全球CFPS市場規模預計將在2025-2030年間以15%-20%的年均復合增長率擴張,其中北美和歐洲占據主導地位。多家生物技術公司(如ThermoFisher、Synthelis、ArborBiotechnologies)已推出商業化無細胞蛋白表達技術試劑盒和服務,覆蓋從科研到工業級的生產需求。尤其在個性化醫療和快速疫苗開發領域,無細胞蛋白表達技術因其短周期、高靈活性成為企業布局的重點,例如在mRNA疫苗生產中用于快速驗證抗原設計。體外蛋白表達作為??現代分子生物學的重...
2025-07-09 -
 外源蛋白表達產業鏈
外源蛋白表達產業鏈傳統微生物發酵生產工業酶面臨周期長(>72 小時)且純化復雜的瓶頸。新一代連續流體外蛋白表達系統 通過耦合反應器實現高效合成:將大腸桿菌裂解物與纖維素酶基因模板泵入螺旋管,在 30℃ 恒溫條件下持續產出酶蛋白,每小時產量達 120 mg/L,較批次反應提高 8 倍。德國 BRAIN AG 公司利用此技術生產 耐熱木聚糖酶,直接添加至造紙漿料中降解半纖維素,使漂白劑用量減少 30%。該系統還支持 實時補料——補充消耗的氨基酸和能量物質可維持 48 小時穩定表達,單位酶成本降至 $2.5/g,逼近發酵法經濟閾值。相比細胞培養,??體外蛋白表達??將xinguanbingdu抗體驗證周期從3周縮短至...
2025-07-09 -
 膜蛋白表達水平
膜蛋白表達水平將體外蛋白表達推向規模化生產需解決三大he xin瓶頸:裂解物制備標準化問題:不同批次細胞破碎效率差異導致核酸酶/蛋白酶殘留量波動(CV>15%),造成翻譯活性離散度超20%。能量再生持續性不足:即使采用多酶耦聯再生系統(如pyruvate kinase,PK-肌激酶級聯),ATP濃度常在反應啟動6小時后衰減至閾值(<1 mM)以下,大幅限制長時程蛋白表達效率。產物濃度天花板效應:受限于核糖體組裝速率(約10個核糖體/分鐘/條mRNA),當前比較高產量只達5-8 g/L,較CHO細胞灌注培養系統(>10 g/L)仍有明顯差距。為突破這些限制,前沿策略聚焦于 工程化裂解物開發—通過CRISPR敲...
-
 CHO細胞蛋白表達服務
CHO細胞蛋白表達服務從實驗室走向產業化,無細胞蛋白表達技術還面臨多重障礙。規模化生產時,反應體系的均一性和重復性難以保證,且大規模制備高活性裂解物的成本效益比仍需優化。在下游純化環節,由于反應混合物中含有大量核酸、酶和其他細胞組分,目標蛋白的分離純化步驟比傳統方法更復雜。此外,目前大多數CFPS工藝仍處于分批反應模式,連續化生產設備的開發滯后,限制了其在工業流水線中的應用潛力。盡管存在這些挑戰,隨著微流控技術、人工智能優化反應條件等新方法的引入,CFPS技術正在逐步突破這些產業化瓶頸。添加0.5mM PMSF將 ??體外表達蛋白的降解率??從45%壓制至
2025-07-09 -
 無細胞蛋白表達
無細胞蛋白表達無細胞蛋白表達技術的模板可以是線性DNA(如PCR產物)或環狀質粒,需包含啟動子(如T7/T3/SP6)和核糖體結合位點(RBS)以啟動轉錄翻譯。為提升效率,系統可能添加分子伴侶(如DnaK/GroEL)輔助蛋白折疊,或氧化還原劑(如谷胱甘肽)促進二硫鍵形成。部分高級系統(如PURE體系)使用純化重組元件替代粗提物,實現更高可控性,但成本較高。無細胞蛋白表達技術可靈活引入非天然氨基酸(nnAA),擴展了蛋白質的功能多樣性。例如,通過定制tRNA和氨酰-tRNA合成酶,無細胞蛋白表達技術系統能準確將熒光標記或交聯基團嵌入目標蛋白,用于結構生物學或藥物偶聯開發。更前沿的應用是人工生命體系的構建,如...
-
 293t蛋白表達載體構建
293t蛋白表達載體構建在小規模、快速驗證性實驗中,無細胞蛋白表達技術(CFPS)的性價比優勢明顯。其單次反應成本約200-500元(含商業化裂解物和模板),雖高于大腸桿菌發酵的試劑成本,但可節省大量時間——傳統細胞表達需3-5天(含轉化、培養、誘導),而CFPS只需4-8小時即可獲得ug-mg級蛋白,尤其適合藥物篩選、突變體庫構建等時效性需求。例如,某CRO公司采用CFPS一周內完成50種抗體變體的活性測試,而傳統方法只能完成5-10種,人力與設備成本大幅降低。把細胞的“蛋白生產工具”倒進試管,加點基因“設計圖”和原料,幾小時就能??進行蛋白表達。293t蛋白表達載體構建在無細胞合成生物學的框架下,可編程分子制造引...
2025-07-09 -
 293t蛋白蛋白表達濃度
293t蛋白蛋白表達濃度相較于原核表達體系,真核體外蛋白表達的he xin優勢在于具備部分翻譯后修飾能力,但 關鍵修飾途徑仍存在明顯局限。在缺乏內質網-高爾基體轉運機制的情況下,糖基化修飾通常終止于高甘露糖型(Man?GlcNAc?)階段,無法合成復雜雙觸角唾液酸化糖鏈。這一缺陷直接影響zhi liao性抗體的抗體依賴性細胞介導的細胞毒性(ADCC)效應。同時,裂解物中二硫鍵異構酶(PDI)與分子伴侶(如BiP)的活性不足,導致含多對二硫鍵的蛋白錯誤折疊率升高40%-60%。為克服此瓶頸,需在裂解物中外源性添加重組糖基轉移酶復合體(如GnT-I/GnT-II/FUT8)以重構修飾途徑,并通過優化氧化還原電勢(Eh=-...
2025-07-09 -
 目的蛋白表達條件篩選
目的蛋白表達條件篩選無細胞蛋白表達技術的模板可以是線性DNA(如PCR產物)或環狀質粒,需包含啟動子(如T7/T3/SP6)和核糖體結合位點(RBS)以啟動轉錄翻譯。為提升效率,系統可能添加分子伴侶(如DnaK/GroEL)輔助蛋白折疊,或氧化還原劑(如谷胱甘肽)促進二硫鍵形成。部分高級系統(如PURE體系)使用純化重組元件替代粗提物,實現更高可控性,但成本較高。無細胞蛋白表達技術可靈活引入非天然氨基酸(nnAA),擴展了蛋白質的功能多樣性。例如,通過定制tRNA和氨酰-tRNA合成酶,無細胞蛋白表達技術系統能準確將熒光標記或交聯基團嵌入目標蛋白,用于結構生物學或藥物偶聯開發。更前沿的應用是人工生命體系的構建,如...
-
 哺乳動物蛋白表達上調
哺乳動物蛋白表達上調tumor靶向zhi liao需快速檢測患者特異性生物標志物。基于體外蛋白表達的液態活檢-功能驗證平臺將ctDNA突變轉化為功能蛋白:從患者血漿提取BRAFV600E突變DNA,加入兔網織紅細胞裂解物表達突變激酶,再通過微流控芯片檢測其與抑制劑Dabrafenib的結合力(Clin.CancerRes.,2023)。全程只需8小時(傳統細胞驗證需2周),指導黑色素瘤準確用藥的準確率達92%。該技術正拓展至EGFR/ALK融合蛋白檢測,推動個體化醫療進程。英國nuclera蛋白質打印機可鋪助體外蛋白表達,更多產品信息,可咨詢上海曼博生物! 大腸桿菌體外蛋白表達的單次反應成本($1.5)只為哺...
2025-07-09 -
 分泌蛋白表達檢測
分泌蛋白表達檢測國內生物醫藥行業對CFPS的價值認知不足,傳統企業更依賴成熟的細胞表達系統(如CHO、大腸桿菌)。許多藥企認為無細胞蛋白表達技術只適用于“科研級小試”,對其在藥物開發(如ADC定點偶聯)、mRNA疫苗抗原快速制備等工業化潛力持觀望態度。同時,無細胞蛋白表達技術在復雜蛋白表達(如糖基化抗體)上的局限性也削弱了市場信心。相比之下,歐美已形成“CRO+藥企”的協同生態(如Moderna與CFPS服務商合作),而國內缺乏此類模范案例,導致技術推廣缺乏驅動力。兔網織紅細胞裂解物??含??成熟血紅蛋白合成機制??,能實現復雜酶活性分子的功能性蛋白表達。分泌蛋白表達檢測相較于原核表達體系,真核體外蛋白表達的...
2025-07-09 -
 差異蛋白表達方法
差異蛋白表達方法體外蛋白表達正在推動 無細胞合成生物學 的范式革新:人工代謝通路重構: 在裂解物中整合多酶級聯反應,利用底物通道效應實現小分子化合物的高轉化率合成;基因振蕩器開發: 通過T7 RNA聚合酶的自調控表達構建分子鐘,模擬細胞周期節律;仿生細胞構建: 將蛋白表達系統封裝于脂質體內,結合ATP再生模塊(如bing tong酸激酶系統)創建可自我維持的人工細胞雛形。這種 “設計-構建-測試”閉環 明顯加速了生物系統的理性設計進程。nuclera 高通量微流控蛋白表達篩選系統可助力體外蛋白表達,如想了解更多信息,歡迎咨詢官方代理商上海曼博生物!自供能體外蛋白表達??系統是構建人工細胞的重要路徑。差異蛋白表...
2025-07-09 -
 iptg誘導蛋白表達水平
iptg誘導蛋白表達水平將體外蛋白表達推向規模化生產需解決三大he xin瓶頸:裂解物制備標準化問題:不同批次細胞破碎效率差異導致核酸酶/蛋白酶殘留量波動(CV>15%),造成翻譯活性離散度超20%。能量再生持續性不足:即使采用多酶耦聯再生系統(如pyruvate kinase,PK-肌激酶級聯),ATP濃度常在反應啟動6小時后衰減至閾值(<1 mM)以下,大幅限制長時程蛋白表達效率。產物濃度天花板效應:受限于核糖體組裝速率(約10個核糖體/分鐘/條mRNA),當前比較高產量只達5-8 g/L,較CHO細胞灌注培養系統(>10 g/L)仍有明顯差距。為突破這些限制,前沿策略聚焦于 工程化裂解物開發—通過CRISPR敲...
-
 融合蛋白表達修飾
融合蛋白表達修飾無細胞蛋白表達技術(CFPS)根據反應體系的設計可分為分批式(Batch)、雙層式(Bilayer)和連續交換式(CECF)三種主要形式。分批式是Zui基礎的形式,反應在單一試管中進行,操作簡單但受限于底物耗盡和副產物積累,表達時間通常只4小時,適合小規模篩選(如Promega的試劑盒)。雙層式通過密度差異將反應液與緩沖液分層,延長反應時間至8-20小時,日本CFS公司的產品采用此設計。連續交換式(CECF)通過半透膜連接反應室與供應室,持續補充底物并移除副產物,可將反應延長至24小時,產量明顯提高(如德國RTS系統的1mL及以上規模產品)通過微型化??體外蛋白表達??系統,24小時內測試了5...
2025-07-09 -
 大腸桿菌重組蛋白表達市場現狀
大腸桿菌重組蛋白表達市場現狀無細胞蛋白表達技術在快速響應公共衛生事件和jun shi應用中表現突出。例如,在COVID-19期間,無細胞蛋白表達技術被用于數小時內合成病毒抗原,加速疫苗候選物篩選。美國DARPA支持的“生物制造”項目利用凍干無細胞蛋白表達技術試劑,在戰場環境中按需生產止血蛋白或抗體,實現便攜式、無需冷鏈的即時生物制造。這類場景凸顯了無細胞蛋白表達技術在時效性和環境適應性上的不可替代性。根據應用需求,無細胞蛋白表達技術可整合非天然氨基酸(通過修飾tRNA)、脂質體(用于膜蛋白表達)或翻譯后修飾酶(如糖基化酶)。原核蛋白表達速度快,但??真核蛋白表達??更接近天然結構。大腸桿菌重組蛋白表達市場現狀根據模板設計...
2025-07-09 -
 大分子蛋白表達陽性
大分子蛋白表達陽性無細胞蛋白表達技術(CFPS)正在徹底改變合成生物學、生物技術和藥物開發等關鍵領域,它通過突破傳統大腸桿菌(E. coli)等細胞表達系統的固有局限,實現了三大he xin優勢:更快的生產周期更靈活的合成條件調控;可表達毒性蛋白或體內難以合成的復雜結構蛋白;這使得CFPS成為zhi liao性蛋白開發、功能基因組學和高通量蛋白質篩選不可或缺的工具。由于擺脫了細胞代謝的束縛,CFPS可實時優化反應條件,從而明顯提升蛋白產量并優化生產效率。大腸桿菌裂解物??是經濟的體外蛋白表達平臺。大分子蛋白表達陽性無細胞蛋白表達技術因其操作簡單、周期短,已成為生物教學的理想工具。學生可在實驗課中直接觀察綠色熒光...
2025-07-09 -
 酵母蛋白表達定位
酵母蛋白表達定位20世紀90年代后,隨著分子生物學和合成生物學的進步,無細胞蛋白表達技術技術迎來突破。研究者通過優化裂解物制備(如敲除大腸桿菌核酸酶)、開發能量再生系統(如Phosphoenolpyruvic acid,PEP循環),明顯提升蛋白產量和反應時長。2000年代初,連續交換式反應體系(CECF)的出現解決了底物耗盡問題,使反應時間延長至24小時以上,產量達毫克級,為工業化鋪平道路。此階段,無細胞蛋白表達技術開始應用于毒性蛋白合成和抗體片段生產,但成本仍較高。無細胞體系的開放性??允許直接添加非天然氨基酸,擴展了??體外表達蛋白??的化學多樣性。酵母蛋白表達定位將體外蛋白表達推向規模化生產需解決三大...
-
 常用蛋白表達原理
常用蛋白表達原理從實驗室走向產業化,無細胞蛋白表達技術還面臨多重障礙。規模化生產時,反應體系的均一性和重復性難以保證,且大規模制備高活性裂解物的成本效益比仍需優化。在下游純化環節,由于反應混合物中含有大量核酸、酶和其他細胞組分,目標蛋白的分離純化步驟比傳統方法更復雜。此外,目前大多數CFPS工藝仍處于分批反應模式,連續化生產設備的開發滯后,限制了其在工業流水線中的應用潛力。盡管存在這些挑戰,隨著微流控技術、人工智能優化反應條件等新方法的引入,CFPS技術正在逐步突破這些產業化瓶頸。芯片級體外蛋白表達平臺在個性化醫療中尤為關鍵,能夠幫助指導靶向藥物選擇。常用蛋白表達原理相較于傳統細胞表達系統,體外蛋白表達的he...
-
 定制蛋白表達protocol
定制蛋白表達protocol提升體外蛋白表達效能的關鍵技術路徑包括:裂解物工程化改造: CRISPR敲除核酸酶/蛋白酶基因增強穩定性,或過表達分子伴侶(如GroEL/ES)改善折疊;能量再生系統強化: 耦合葡萄糖脫氫酶與ATP合成酶模塊,實現ATP持續再生;膜蛋白表達突破: 添加脂質納米盤(Nanodiscs)提供類膜環境,促進跨膜結構域正確折疊;高通量篩選適配: 微流控芯片實現萬級反應并行運行,單次篩選規模超越傳統細胞方法。這些策略共同推動該技術向 更高效率、更低成本、更廣適用性 演進。體外蛋白表達作為??現代分子生物學的重要工具之一??。定制蛋白表達protocol無細胞蛋白表達技術的市場潛力主要來自三大驅動力:藥物...
-
 分泌型蛋白表達檢測
分泌型蛋白表達檢測相較于原核表達體系,真核體外蛋白表達的he xin優勢在于具備部分翻譯后修飾能力,但 關鍵修飾途徑仍存在明顯局限。在缺乏內質網-高爾基體轉運機制的情況下,糖基化修飾通常終止于高甘露糖型(Man?GlcNAc?)階段,無法合成復雜雙觸角唾液酸化糖鏈。這一缺陷直接影響zhi liao性抗體的抗體依賴性細胞介導的細胞毒性(ADCC)效應。同時,裂解物中二硫鍵異構酶(PDI)與分子伴侶(如BiP)的活性不足,導致含多對二硫鍵的蛋白錯誤折疊率升高40%-60%。為克服此瓶頸,需在裂解物中外源性添加重組糖基轉移酶復合體(如GnT-I/GnT-II/FUT8)以重構修飾途徑,并通過優化氧化還原電勢(Eh=-...
2025-07-09 -
 293t蛋白表達難點
293t蛋白表達難點無細胞蛋白表達技術在藥物研發領域具有明顯優勢,尤其適用于快速生產zhi liao性蛋白、抗體和疫苗抗原。例如,在COVID-19期間,研究人員利用CFPS在幾小時內合成COVID-19刺突蛋白的RBD結構域,大幅加速了疫苗候選分子的篩選和驗證。此外,該技術可高效表達傳統細胞系統難以生產的毒性蛋白(如某些抗ai藥物靶點)或易降解蛋白(如細胞因子),并支持非天然氨基酸插入,為抗體藥物偶聯物(ADCs)的開發提供準確修飾平臺。相比哺乳動物細胞培養(通常需要1-2周),CFPS可在24小時內完成從基因到蛋白的全流程,明顯縮短藥物發現周期。例如HIV蛋白酶在通過體外蛋白表達后仍切割底物蛋白,但其毒性被限...
2025-07-09 -
 常用蛋白表達陽性
常用蛋白表達陽性無細胞蛋白表達技術(CFPS)在毒性蛋白和膜蛋白的合成中展現出獨特優勢。傳統細胞系統難以表達具有細胞毒性的蛋白(如溶菌酶、限制性內切酶),而無細胞蛋白表達技術通過體外開放環境規避了宿主細胞存活限制,可高效合成活性毒蛋白,例如珀羅汀生物成功表達的BamHI內切酶,其Minimun活性濃度只需0.001μg/μL。此外,無細胞蛋白表達技術通過添加表面活性劑或脂質體模擬膜環境,實現了全長跨膜蛋白(如CLDN18.1)的可溶表達,純度達80%以上,為藥物靶點開發提供了關鍵工具。優化后的??原核體外蛋白表達??已廣泛應用于抗體篩選、酶工程等領域。常用蛋白表達陽性國內生物醫藥行業對CFPS的價值認知不足,...
-
 293蛋白表達包涵體
293蛋白表達包涵體在合成生物學中,無細胞蛋白表達技術是構建人工細胞和基因電路的he xin工具。研究人員通過混合不同物種(如大腸桿菌+哺乳動物)的裂解物,創建雜合翻譯系統,以實現跨物種蛋白的協同合成。該技術還支持無細胞基因線路的快速原型設計,例如將CRISPR組分與報告蛋白共表達,用于體外診斷工具的開發。由于擺脫了細胞膜的限制,CFPS可直接整合非生物元件(如合成聚合物或納米材料),推動人工合成生命和生物-非生物雜合系統的前沿研究。無細胞蛋白表達技術可快速表達膜蛋白(如GPCRs、離子通道)用于藥物靶點研究,解決了此類蛋白在細胞內難表達、易沉淀的問題。在診斷領域,基于CFPS的體外轉錄-翻譯系統被整合到便攜式設...
2025-07-09