嘉興全自動膜片鉗實驗應用
膜片鉗在通道研究中的重要作用:對離子通道生理與病理情況下作用機制的研究:通過對各種生理或病理情況下細胞膜某種離子通道特性的研究,了解該離子的生理意義及其在疾病過程中的作用機制。如對鈣離子在腦缺血神經細胞損害中作用機制的研究表明,缺血性腦損害過程中,Ca2+ 介導現象起非常重要的作用,缺血缺氧使Ca2+通道開放,過多的Ca2+進入細胞內就出現Ca2+超載,導致神經元及細胞膜損害,膜轉運功能障礙,嚴重的可使神經元壞死。膜片破裂再將玻管慢慢地從細胞表面垂直地提起,斷端游離部分自行融合成脂質雙層。嘉興全自動膜片鉗實驗應用

膜片鉗的數據如何處理:穿孔膜片(perforated patch)是為克服常規全細胞模式的胞質滲漏問題,有學者將與離子親和的制霉菌素或二性霉素b經微電極灌流到含有類甾醇的細胞膜上,形成只允許一價離子通過的孔,用此法在膜片上做很多導電性孔道,借此對全細胞膜電流進行記錄。由于此模式的胞質滲漏極為緩慢,局部串聯阻抗較常規全細胞模式高,所以鉗制速度很慢,也稱為緩慢全細胞模式。它適合于小細胞的電壓鉗位,對于直徑大于30μm的細胞很難實現鉗位。不足之處是由于電極與細胞間交換快,細胞內環境很容易破壞,因此記錄所用的電極液應與胞漿主要成分相同,如高k+,低na+和ca2+及一定的緩沖成分和能量代謝所需的物質。膜片鉗技術用特制的玻璃微吸管吸附于細胞表面,使之形成10~100MΩ的高阻封接,被孤立的小膜片面積為微米數量級,因此封接范圍內細胞膜光有少數離子通道。無錫藥理學膜片鉗成像方案膜片鉗使用操作流程及注意事項:實驗結束后必須關閉實驗室的水電。
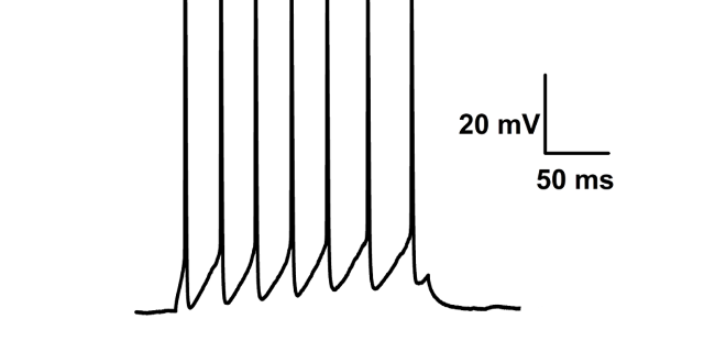
膜片鉗在通道研究中的重要作用:用膜片鉗技術可以直接觀察和分辨單離子通道電流及其開閉時程、區分離子通道的離子選擇性、同時可發現新的離子通道及亞型,并能在記錄單細胞電流和全細胞電流的基礎上進一步計算出細胞膜上的通道數和開放概率,還可以用以研究某些胞內或胞外物質對離子通道開閉及通道電流的影響等。同時用于研究細胞信號的跨膜轉導和細胞分泌機制。結合分子克隆和定點突變技術,膜片鉗技術可用于離子通道分子結構與生物學功能關系的研究。
膜片鉗技術基本原理與特點:此密封不光電學上近乎絕緣,在機械上也是較牢固的。又由于玻璃微電極管徑很小,其下膜面積光約1 μm2,在這么小的面積上離子通道數量很少,一般只有一個或幾個通道,經這一個或幾個通道流出的離子數量相對于整個細胞來講很少,可以忽略,還特需防震工作臺、屏蔽罩、膜片鉗放大器、三維液壓操縱器、倒置顯微鏡、數據采集卡、數據記錄和分析系統等。也就是說電極下的離子電流對整個細胞的靜息電位的影響可以忽略,那么,只要保持電極內電位不變,則電極下的一小片細胞膜兩側的電位差就不變,從而實現電位固定。膜片鉗技術用于紀錄全細胞或個別細胞膜上離子信道電生理特性的研究方法。

膜片鉗技術是用于紀錄全細胞或個別細胞膜上離子信道電生理特性的研究方法,目的在于提供基礎研究知識與新藥開發時研究細胞電特性或小分子藥物對細胞膜上離子信道特性的影響,替開發標靶藥物提供一個測試平臺。傳統的細胞培養膜片鉗系統由人工操作,實驗人員在取得元代細胞(例如心肌細胞與神經元)后,將研究對象細胞養在玻片上,以手動方式將紀錄電極移動放置在胞體上方并壓到細胞膜上,此時紀錄電極在膜外溶液里的電阻大約為3-9 ΜΩ。膜片鉗系統有如下應用局限性:在紀錄對象上,目前的膜片鉗系統只能紀錄胞膜形狀平整飽滿的細胞。東莞醫學膜片鉗電生理技術網站
膜片鉗系統有如下應用局限性:光能應用于懸浮細胞的紀錄。嘉興全自動膜片鉗實驗應用
膜片鉗技術基本原理與特點:膜片鉗技術本質上也屬于電壓鉗范疇,兩者的區別關鍵在于:①膜電位固定的方法不同;②電位固定的細胞膜面積不同,進而所研究的離子通道數目不同。電壓鉗技術主要是通過保持細胞跨膜電位不變,并迅速控制其數值,以觀察在不同膜電位條件下膜電流情況。因此只能用來研究整個細胞膜或一大塊細胞膜上所有離子通道活動。目前電壓鉗主要用于巨大細胞的全性能電流的研究,特別在分子克隆的卵母細胞表達電流的鑒定中發揮著其他技術不能替代的作用。該技術的主要缺陷是必須在細胞內插入兩個電極,對細胞損傷很大,在小細胞如神經元,就難以實現,又因細胞形態復雜,很難保持細胞膜各處生物特性的一致。嘉興全自動膜片鉗實驗應用
- 南京高精確度免疫電鏡技術服務中心 2025-02-07
- 珠海抗原定位免疫電鏡檢測 2025-02-07
- 廣州細菌免疫電鏡技術應用 2025-02-07
- 常州抗體反應免疫電鏡技術哪家好 2025-02-06
- 高精確度免疫電鏡技術哪家靠譜 2025-02-06
- 上海病毒免疫電鏡技術平臺 2025-02-06
- 湖州抗原定位免疫電鏡檢測服務 2025-02-05
- 寧波抗體反應免疫電鏡技術哪家好 2025-02-05
- 福州免疫電鏡檢測服務中心 2025-02-05
- 蕪湖免疫性疾病免疫電鏡技術服務中心 2025-01-27
- 波絡彌達養生 2025-02-07
- 江蘇下肢矯形器支架 2025-02-07
- 紹興哪里有艾德萊RNA提取試劑盒市場報價 2025-02-07
- 山東菌燕益生元 2025-02-07
- 資生堂膠原蛋白肽口服液代工廠 2025-02-07
- 浙江眼部精華哪個好用 2025-02-07
- 天津下肢矯形器支架 2025-02-07
- 高靈敏度宿主蛋白殘留檢測試劑盒 2025-02-07
- 口服美白膠原蛋白 2025-02-07
- 陜西定做矯形器下肢器材 2025-02-07