南京正規外泌體提取試劑單價
1983年,外泌體初次于綿羊網織紅細胞中被發現,1987年Johnstone將其命名為“exosome”。多種細胞在正常及病理狀態下均可分泌外泌體。其主要來源于細胞內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中。所有培養的細胞類型均可分泌外泌體,且外泌體天然存在于體液中,包括血液、唾液、尿液、腦脊液和乳汁中。有關他們分泌和攝取及其組成、“運載物”和相應功能的精確分子機制剛剛開始研究。外泌體目前被視為特異性分泌的膜泡,參與細胞間通訊,對外泌體的研究興趣日益增長,無論是研究其功能還是了解如何將其用于微創診斷的開發。如何高效地提取外泌體是實現這項新興液體活檢技術臨床常規化應用的關鍵。外泌體提取:回收率不穩定(可能與轉子類型有關),純度也受到質疑。南京正規外泌體提取試劑單價
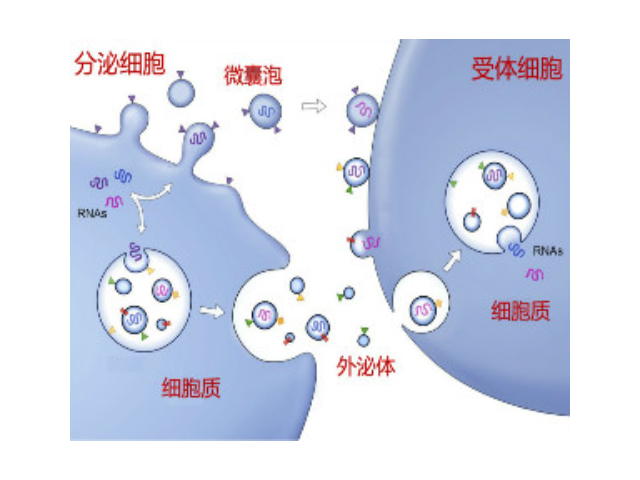
外泌體相關蛋白質與肺病的診斷:近年來,高通量質譜分析被普遍地應用于篩選NSCLC外泌體蛋白的研究,這為我們揭示了更多具有生物標志物價值的分子。Birgitte等采用微陣列芯片技術研究了431例肺病患者和150例對照者血漿外泌體中的蛋白表達情況,發現CD151、CD171和TSPAN8這三種蛋白表達不光能區分一些病癥與正常組織,同時也能區分各種肺病的組織亞型。此外,聯合應用這三種蛋白診斷NSCLC的AUC達到0.74。Clark等采用納升液聯用技術(nano-ESI-LC-MS/MS)分析了來自正常支氣管上皮細胞系和兩個攜帶NSCLC細胞系的外泌體的蛋白表達譜,從中篩選出如細胞外基質金屬蛋白酶誘導因子、溶酶體膜糖蛋白2等多種存在顯著性差異表達的蛋白,同時檢測分析這些蛋白有助于提高NSCLC診斷的敏感性和特異性。由于國內有關外泌體提取試劑的缺乏,我國對外泌體的研究還基本依賴于過程繁瑣的超速離心和進口提取試劑盒。杭州外泌體提取試劑哪家好使用PBS對膜進行洗脫即得到外泌體濃縮液。

外泌體的形成與鑒定:首先,細胞膜內陷形成一個杯狀結構,包括細胞表面蛋白和與細胞外環境相關的可溶性蛋白,導致早期胞內體(early-sortingendosome,ESE)的從頭形成,或者是杯狀結構直接和已經存在的ESEs融合;trans-高爾基體和內質網也能協助形成ESEs。ESE成熟后形成晚期胞內體(late-sortingendosomes,LSEs),較終形成MVBs(也稱為多囊內小體)。MVBs是通過endosome限制膜向內凹(即質膜雙凹)形成的,這一過程導致MVBs含有多個ILVs。MVB可以與溶酶體或自噬體融合,較終降解或與質膜融合釋放作為外泌體的ILVs。外泌體表面蛋白包括四聚體蛋白、整合蛋白、免疫調節蛋白等。外泌體可以包含不同類型的細胞表面蛋白、細胞內蛋白、RNA、DNA、氨基酸和代謝物。使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后。
外泌體的提取、分離方法:開發高效、快速、穩定,并且保持外泌體結構和生物功能完整性的方法,是目前外泌體應用于臨床的基礎和前提。從細胞上清和體液中提取分離外泌體的方法很多,但是外泌體的純度和產量卻和分離方法息息相關。通常分離步驟少、產率高,但是純度會受到影響。鑒于每種分離方法都有其優缺點,實驗可以根據樣本來源、下游實驗目的等,選擇合適的外泌體分離方法。2015年,國際囊泡組織(InternationSocietyforExtracelluarVesicles,ISEV)指出,簡單依靠一種分離方法得到的外泌體的純度和產量都難滿足實驗的需求。因此,推薦聯合使用各種方法,從而得到高純度和高產量的外泌體。有的是通過特殊設計的過濾器過濾掉雜質成分,有的則采用空間排阻色譜法(SEC)進行分離純化。
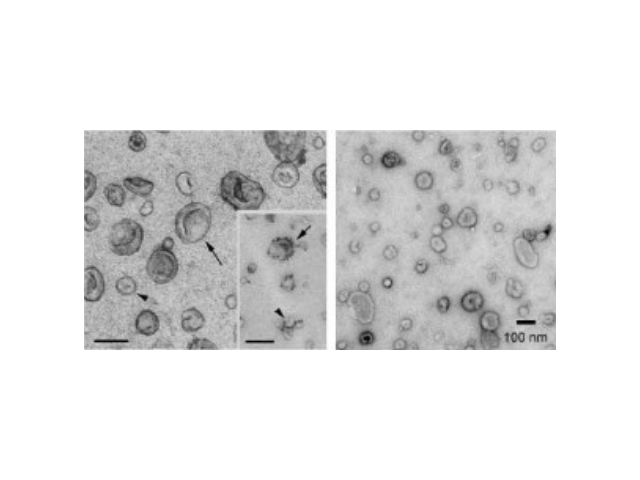
外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感。現已證實可以分泌外泌體的細胞有:肥大細胞、淋巴細胞、樹突狀細胞、一些病癥細胞、間充質干細胞等。杭州外泌體提取試劑銷售廠家
外泌體提純試劑盒的特色與優勢:外泌體被純化并且不含任何其他RNA結合蛋白。南京正規外泌體提取試劑單價
CD47是信號調節蛋白α(SIRPα,也稱為CD172a)的配體,CD47-SIRPα間的結合能夠發出“不要吃我”的信號,從而壓制吞噬作用。病基因RAS能夠促進胰腺病細胞增殖,增強胞飲作用從而促進一些病癥細胞攝取外泌體。合成納米顆粒對細胞有一定毒性作用,但使用外泌體能夠較小化對細胞的毒性。研究人員發現,CD47和病基因KRAS驅動的胞飲作用都會壓制外泌體被循環系統的清理,并增強胰腺病細胞對外泌體的特異性。所以,外泌體的這種特性增強了它們通過遞送RNAi來特異性靶向胰腺病中的KRAS的能力,并且使用外泌體作為單一靶向劑顯著改善了所有實驗PDAC小鼠模型的總生存期。南京正規外泌體提取試劑單價
- 寧波無血清細胞凍存液推薦廠家 2025-02-08
- 合肥正規細胞外基質膠價格 2025-02-08
- 廈門無血清細胞凍存液直銷廠家 2025-02-08
- 深圳正規細胞外基質膠單價 2025-02-08
- 正規無血清細胞凍存液價格 2025-02-08
- 深圳正規無血清細胞凍存液哪家便宜 2025-02-08
- 廈門正規細胞外基質膠 2025-02-08
- 上海重慶無血清細胞凍存液 2025-02-08
- 長沙無血清細胞凍存液平均價格 2025-02-08
- 寧波無血清細胞凍存液銷售廠家 2025-02-08
- 冰熊RL32H中央空調壓縮機油批發商 2025-02-08
- 江西純凈水處理設備 2025-02-08
- 浙江透明UV膠批發商 2025-02-08
- 寧波無血清細胞凍存液推薦廠家 2025-02-08
- 揚州水溶性水性清洗劑生產 2025-02-08
- 遼寧麥克維爾B油中央空調壓縮機油 2025-02-08
- 常見的蒸餾水廠家銷售電話 2025-02-08
- 開封桶裝乙腈廠家報價 2025-02-08
- 上海超濾水處理設備 2025-02-08
- 上海定制水處理設備哪家好 2025-02-08